近日,孙逊教授课题组利用沙门氏菌驱动的肿瘤乏氧区靶向策略,实现了药物、光热和免疫治疗的高效协同。相关论文发表在Advanced Functional Materials (DOI: 10.1002/adfm.201906623)上,并被materialsviewschina作为亮点文章进行报道。
VNP20009为一类msbB、purI基因缺失的减毒鼠伤寒沙门氏菌菌株,其安全性已在多个临床前和临床Ⅰ期实验中被证实,但因其在安全剂量下,未显示明显的抑瘤效果,多项临床试验终止于Ⅰ期。VNP20009用于肿瘤治疗具有两大特点:一是高度靶向肿瘤乏氧区;二是具备抗肿瘤效应。
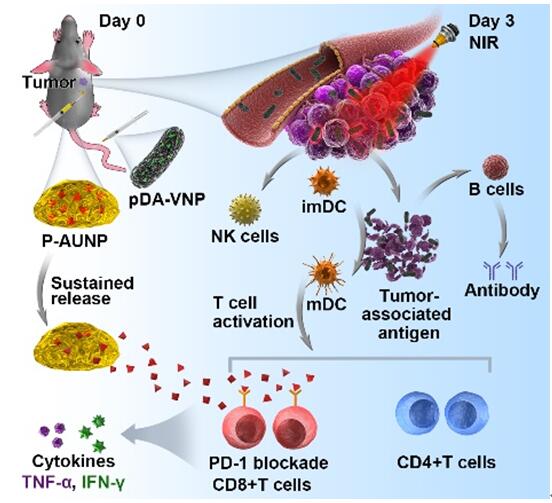
孙逊课题组前期通过多巴胺在碱性溶液中的氧化自聚合反应,使一种仿生光热材料——聚多巴胺成功地包裹于这类减毒沙门氏菌VNP20009的表面(pDA-VNP),用于细菌与光热的联合抗肿瘤治疗。聚多巴胺具备良好的生物相容性与生物可降解性,光热转化效率较高,为其应用于光热治疗提供依据。该细菌与光热的联合治疗策略为一种互促、共赢的关系:细菌携带光热材料高效地靶向肿瘤深部乏氧区,增强杀伤原位肿瘤的效果;光热治疗则通过高温杀灭原位肿瘤,产生肿瘤细胞裂解物,一方面可作为“自身抗原”,激活机体免疫效应,另一方面可作为营养物质,有利于细菌于肿瘤部位的继续繁殖。为了使该治疗策略更好地应用于难以攻克的大体积肿瘤,研究者们又联合应用了一种肽类PD-1/PD-L1免疫检查点抑制剂——AUNP-12,并将其包载于原位磷脂相变凝胶中(P-AUNP)。其通过单次皮下注射,即可形成药物储库,缓释肽类PD-1拮抗剂可达42天,从而持续改善肿瘤免疫抑制微环境,恢复T细胞杀伤肿瘤能力,进而增强药物的抗肿瘤疗效,抑制肿瘤后期的复发与转移。该细菌、光热与免疫的三重联合治疗策略,揭示了近年来大家所忽略的细菌疗法的免疫作用部分,为肿瘤免疫治疗提供了一种新思路。
以上研究得到国家自然科学基金、四川省科技重大专项以及中央高校基本科研业务费专项资金资助,主要由博士研究生陈雯霏等人完成。
来源:学科发展办 编辑:四川大学华西药学院
